Carles Romea
La protección en las estructuras metálicas (III)
Categorias

La corrosión de los metales
Vimos en los artículos anteriores dedicados a la corrosión de los metales (II) y estructuras metálicas, la existencia de la conocida como Serie Galvánica a partir de la tendencia que tiene un metal a sufrir la corrosión.Vemos que el oro, el primero de la serie, es el que tiene el mayor potencial positivo con respecto al “normal” standard, que es el Hidrogeno, mientras que, en la parte negativa encontramos en la parte baja al aluminio, al hierro y al zinc. Esto quiere decir que el oro puede corroer a todos los demás, es decir les hace cederle electrones, por tanto los va reduciendo, y con el tiempo se descomponen.  Valores de los potenciales de la serie galvánica Vemos pues, en el esquema anterior, que el cátodo, oxidante siempre lo ejerce el metal de mayor potencial E0 de la serie, el más “noble”, mientras que el ánodo es aquel que tiene menor potencial, es decir el menos “noble”. Cuanto mayor es el potencial normal mayor es su poder oxidante. Puede darse la circunstancia de que se tenga un solo metal, que por oxidación, se corroe.Esta corrosión será mayor o menor según su nobleza.
Valores de los potenciales de la serie galvánica Vemos pues, en el esquema anterior, que el cátodo, oxidante siempre lo ejerce el metal de mayor potencial E0 de la serie, el más “noble”, mientras que el ánodo es aquel que tiene menor potencial, es decir el menos “noble”. Cuanto mayor es el potencial normal mayor es su poder oxidante. Puede darse la circunstancia de que se tenga un solo metal, que por oxidación, se corroe.Esta corrosión será mayor o menor según su nobleza. 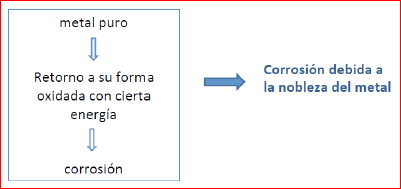 Corrosión de un metal en función de su nobleza Puede darse el caso de que sean dos los metales que interaccionan; entonces de acuerdo con la serie galvánica, existirá entre ambos una diferencia de potencial según el lugar que ocupen en la serie.El más noble oxida el menos noble que se reduce, se corroe.
Corrosión de un metal en función de su nobleza Puede darse el caso de que sean dos los metales que interaccionan; entonces de acuerdo con la serie galvánica, existirá entre ambos una diferencia de potencial según el lugar que ocupen en la serie.El más noble oxida el menos noble que se reduce, se corroe. 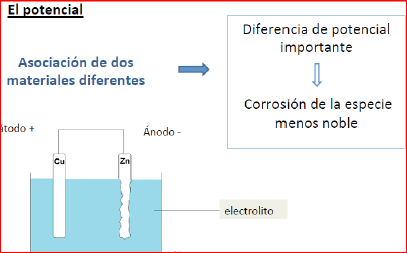 Pila galvánica entre dos metales y un electrolito. En el caso de las aleaciones entre dos metales, como es el caso del acero, en donde actuan el hierro Fe y el carbono C, o el latón, aleación de cobre Cu y Zinc Zn,existe siempre una cierta diferencia de potencial, siendo el de menor potencial, el menos noble el que se corroe.Pero al estar mezclados en el Zn, en este caso menos noble, al corroerse, produce un efecto de material poroso resultante, que degrada la superficie en contacto con el medio ambiente.
Pila galvánica entre dos metales y un electrolito. En el caso de las aleaciones entre dos metales, como es el caso del acero, en donde actuan el hierro Fe y el carbono C, o el latón, aleación de cobre Cu y Zinc Zn,existe siempre una cierta diferencia de potencial, siendo el de menor potencial, el menos noble el que se corroe.Pero al estar mezclados en el Zn, en este caso menos noble, al corroerse, produce un efecto de material poroso resultante, que degrada la superficie en contacto con el medio ambiente. 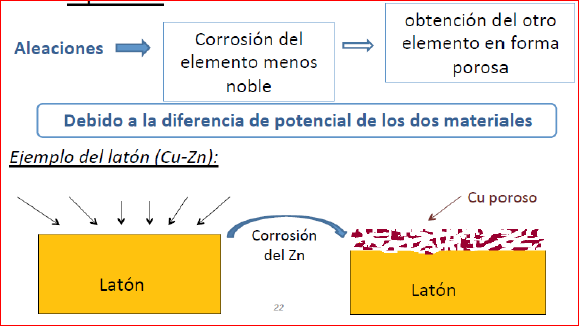 Efecto de la corrosión en aleaciones de dos metales En el caso del acero, este efecto degradante del Fe, provoca unos productos resultantes fruto de la corrosión en forma de material descompuesto en la superficie, que va penetrando con el tiempo hacia todo el conjunto. Los factores ambientales, su agresividad, y sus condiciones de presión y temperatura afectan en mayor o menor medida, acelerando el proceso de deterioro del metal, provocando que la corrosión, reacción quimica redox, de carácter electroquímico afecte a la integridad del metal.
Efecto de la corrosión en aleaciones de dos metales En el caso del acero, este efecto degradante del Fe, provoca unos productos resultantes fruto de la corrosión en forma de material descompuesto en la superficie, que va penetrando con el tiempo hacia todo el conjunto. Los factores ambientales, su agresividad, y sus condiciones de presión y temperatura afectan en mayor o menor medida, acelerando el proceso de deterioro del metal, provocando que la corrosión, reacción quimica redox, de carácter electroquímico afecte a la integridad del metal. 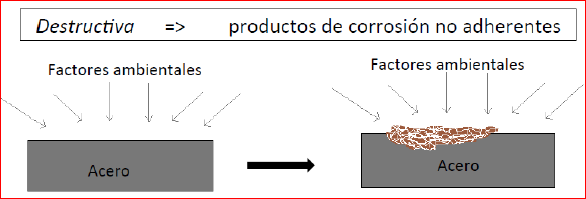 Efecto de la corrosión en el acero. Estas condiciones ambientales, según se trate de un metal, una aleación, el conjunto de dos metales, produce sobre los metales efectos diferentes.La corrossión puede manifestarse de diferentes formas, todas ellas perjudiciales para los materiales.
Efecto de la corrosión en el acero. Estas condiciones ambientales, según se trate de un metal, una aleación, el conjunto de dos metales, produce sobre los metales efectos diferentes.La corrossión puede manifestarse de diferentes formas, todas ellas perjudiciales para los materiales. 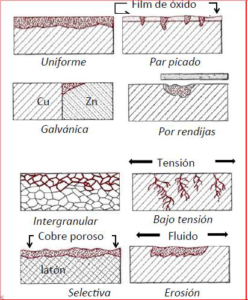 Diferentes efectos de la corrosión en diferentes materiales emtalicos y las normas que los regulan
Diferentes efectos de la corrosión en diferentes materiales emtalicos y las normas que los regulan  Actualmente, en el caso de los metales las normas EN 9223 y EN9224, tratan el caso de la corrosión de los metales y regulan su protección.
Actualmente, en el caso de los metales las normas EN 9223 y EN9224, tratan el caso de la corrosión de los metales y regulan su protección.
Este artículo está relacionado con el Máster Internacional en Estructuras Metálicas y Mixtas de Edificación.